Peu de poissons, dans l’Hexagone, divisent autant les pêcheurs que la truite Arc-en-Ciel Oncorhynchus mykiss (Walbaum 1792), abrégée « TAC » dans la suite du texte. Du plus vil symbole de la pêche « pour la viande » à l’outil essentiel au développement de notre loisir sur certains territoires, sa forte présence dans les politiques halieutiques est un vif débat qui perdure dans le paysage halieutique.
On est d’ailleurs vite tentés d’associer les différentes visions de ce Salmonidé à des considérations plus globales de la pêche de loisir, avec – très grossièrement – une gestion à l’ancienne basée sur des déversements massifs de poissons « prêts à pêcher » d’un côté, et de l’autre une gestion moderne où ce genre lâchers n’a plus lieu, au profit d’empoissonnements avec d’autres espèces ayant moins vocation à visiter un congélateur.
Mais force est de constater que ces débats se basent principalement sur des visions très subjectives de l’halieutisme, et que les enjeux écologiques – supposés ou observés – associés à la TAC rentrent rarement en compte dans ces discussions. Au mieux, on évoque la prédation des truitelles de l’année par ces truites de lâcher, sans réels chiffres à l’appui. L’idée ici sera de voir les impacts documentés de l’espèce dans différents cas d’études, et de discuter des possibilités d’extrapolation de ces impacts chez nous.
Du côté des instances de veille écologique et de conservation, la TAC est assez mal vue, et même considérée comme l’une des espèces les plus envahissantes qui soient actuellement. Elle est d’ailleurs citée dans la liste des 100 « pires espèces invasives au niveau mondial » (traduction littérale, les auteurs reconnaissant eux même la difficulté à déterminer pourquoi une espèce serait pire qu’une autre) (Lowe et al., 2000). Cependant, le taux relativement faible d’acclimatation observée chez l’espèce, malgré l’importance des opérations de repeuplements, conduisent certains chercheurs à discuter son aspect « invasif ». On ne peut cependant nier la capacité d’adaptation assez importante de la TAC, vraisemblablement issue des nombreux croisements de populations réalisés en pisciculture.
Petit disclaimer : cet article n’est pas un pamphlet contre la TAC, ni un manifeste prônant sa suppression de notre paysage halieutique pour des raisons écologiques. Déjà car – selon nous – ce poisson peut être un outil intéressant pour le développement du loisir pêche, mais aussi car de nombreuses espèces moins polémiques, comme la carpe ou le black-bass (qui sont eux aussi sur la liste des 100 « pires espèces exotiques »), ont parfois un impact écologique qui mérite largement une discussion de ce type. Notre volonté est ici de donner des pistes de réflexion sur l’impact de la TAC, pour permettre de construire une considération moins subjective de ce poisson.
Historique
Faisons déjà un petit historique des introductions de l’espèce. Actuellement, la TAC est considérée comme native du bassin Pacifique, de l’Alaska à la Californie pour l’Amérique du Nord, et de la péninsule du Kamchatka côté Russie. Je dis « actuellement » car le regroupement de ces deux populations russe et nord-américaine sous la même espèce est sujet à débat chez les taxonomistes. Certains auteurs considèrent en effet que les TAC du Kamtchatka – ainsi que d’autres Salmonidés de la côte Pacifique eurasienne – n’appartiennent pas au genre Oncorhynchus (genre des Salmonidés du Pacifique), mais à un genre distinct : Parasalmo (Kottelat & Freyhof, 2007) (NDLR : pour plus d'informations sur la notion de genre taxonomique, voir la vidéo Nervurax ici).
Sachez par ailleurs qu’il existe également chez la TAC des sous-populations délimitées par la morphologie et la génétique, à l’instar des dénommées « souches » de truite commune (Salmo trutta), qui font couler tant d’encre chez les truiteux. Et là encore, leur nombre varie selon les auteurs. Ces sous-populations de TAC ont d’ailleurs largement été croisées en pisciculture, ce qui peut également expliquer la grande capacité d’adaptation des poissons élevés et introduits (Stanković et al., 2015).
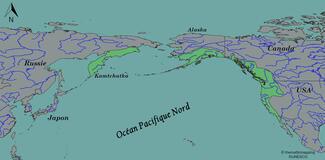
Mais on n’est pas là pour parler taxonomie, alors on va tout simplement suivre le consensus actuel et appeler toutes les TAC – d’où qu’elles viennent – par le même nom : Oncorhynchus mykiss.
L’élevage de l’espèce a démarré au pays de l’Oncle Sam à la fin du XIXème siècle. Fort des premiers constats relatifs aux effets de la surpêche, et face à une demande croissante des pêcheurs de loisir, l’U.S. Fish Commission impulsa un fort développement de l’aquaculture, particulièrement sur les Salmonidés (Crawford et al., 2008 ; Stanković et al., 2015). Il fut ainsi créé, dans cette optique, un vaste réseau de piscicultures et d’écloseries reliées par le rail, qui permettait alors d’envoyer rapidement des truites et saumons, sous forme d’œufs et d’adultes, à travers tout le pays. Ces opérations avaient pour vocation soit de créer de nouvelles populations hors de leur aire de répartition, soit de soutenir des populations déjà existantes (Crawford et al., 2008).
La TAC, supportant bien les conditions d’élevage telles que le nourrissage aux granulés ou la promiscuité et tolérant des températures au-delà de 25°C, occupa rapidement une place importante dans ces échanges. L’origine des premiers spécimens utilisés en pisciculture diffère selon les auteurs : premièrement supposées provenir de la rivière McCloud en Californie (MacCrimmon, 1971), des travaux plus récents évoquent des spécimens originaires de la baie de San Francisco, toujours en Californie. Les premières introductions hors de son aire de répartition native aux USA eurent lieu au milieu des années 1870.

Très vite, des introductions sont tentées outre Atlantique : en 1877, le Japon et la Nouvelle-Zélande voient arriver les premiers œufs de TAC (MacCrimmon, 1971 ; Crawford et al., 2008), provenant respectivement de la « California Fish Commission » et de la Société d’Acclimatation d’Auckland. Le moyen de transport des TAC, et la forme sous laquelle elles furent acheminées (œufs, alevins, adultes) n’est pas réellement connu, bien qu’il soit parfois évoqué des voiliers longs courriers où les œufs étaient « emballés » dans des morceaux de mousse enroulés et conservés dans des blocs de glace (Crawford et al., 2008).
Sans surprise, l’Europe fit rapidement l’objet d’introductions de TAC. Selon les sources, la France et l’Allemagne se disputent le titre de « premier pays d’accueil » de l’espèce sur le continent. Les premiers œufs arrivés en Europe auraient été livrés à l’Aquarium du Trocadéro (Paris) en 1879, mais sans réelles indications sur leur devenir. L’Allemagne, quant à elle, a reçu les premiers œufs des États-Unis en 1882, oeufs qui furent très rapidement distribués dans plusieurs piscicultures, qui servirent de point de départ pour d’autres introductions en Europe, voir dans les colonies (MacCrimmon, 1971 ; Keith & Allardi, 1997 ; Crawford et al., 2008 ; Baglinière et al., 2020). En 1884, la Société d’Acclimatation de Paris fit (re)venir des œufs, lançant l’élevage de l’espèce dans l’Hexagone, qui aboutirent également à des introductions dans les colonies françaises au Maroc et à Madagascar (FAO, 2021).
Le développement de l’espèce en tant que « poisson de sport » – ainsi que les empoissonnements associés – connut un réel essor à partir des années 1950 (Welcomme, 1988). Actuellement, la TAC est signalée dans une centaine de pays, avec des populations acclimatées dans environ la moitié d’entre eux, faisant d’elle le Salmonidé le plus « transloqué » (ie introduit hors de son aire de répartition native) dans le monde, et l’une des espèces de poissons les plus élevées du globe (Stanković et al., 2015). Aujourd’hui encore, on estime qu’environ 680 tonnes de TAC sont lâchées dans les rivières de l’Hexagone chaque année, ce qui en fait la première espèce d’empoissonnement en termes de biomasse (Cucherousset et al., 2021). Nos voisins ne sont pas en reste, avec une production annuelle qui se compte souvent en dizaines de milliers de tonnes, dont une part non-négligeable est dédiée aux déversements. La TAC en devint l’une des espèces exotiques les plus représentées en Europe, voire une des plus représentées tout court, comme en Suisse, par exemple (Wittenberg & Kenis, 2005). Certaines localités comme le lac de Constance (Allemagne, Autriche, Suisse) ont même vu l’apparition de formes migratrices de TAC, les fameuses « steelheads », nom courant donné à la forme écologique migratrice de la TAC naturellement présente en Amérique du Nord (Stanković et al., 2015).
Grandes catégories d’impacts
Évidemment, des questionnements apparurent sur son impact dans les milieux où elle fut introduite, à l’instar d’autres Salmonidés très largement exportés comme l’omble de fontaine (Salvelinus fontinalis) ou la truite commune. Ainsi, dès 1971, Hugh R. MacCrimmon publie une revue des introductions de l’espèce dans le monde et évoque l’absence de recul à propos de l’impact de la TAC sur les autres espèces autochtones qu’elle est amenée à fréquenter.
Faire une revue exhaustive de tous les impacts documentés dans les différentes régions du monde ne serait pas spécialement intéressant (et serait une vraie corvée à lire comme à écrire). Cependant, il est possible de dégager quelques grandes lignes des nombreux travaux réalisés jusqu’à présent.
On peut déjà distinguer deux cas de figure : la présence ou l’absence de Salmonidés autochtones dans les eaux où la TAC est introduite, Ainsi, dans l’Hémisphère Nord, où les Salmonidés sont présents dans quasiment toutes les régions, l’accent est souvent mis sur les interactions que les truites introduites peuvent avoir sur les autochtones, les Salmonidés ayant globalement des niches écologiques similaires :
- Compétition, pour les proies bien sûr, mais aussi l’habitat et les frayères
- Prédation directe (en cas de décalage dans les périodes de reproduction notamment)
- Hybridation et introgression génétique (disparition progressive d’une population par hybridation successives avec un autre population plus répandue et gagnant du terrain).
Dans l’Hémisphère Sud, où les Salmonidés sont très peu présents naturellement, les regards sont portés sur l’impact vis-à-vis des autres taxons, comme les autres poissons, mais aussi des invertébrés aquatiques, voir des amphibiens. Il s’agit le plus souvent de prédation directe des Salmonidés introduits sur ces taxons, bien que l’on reporte également le transport de pathogènes par le biais des poissons lâchés.
Évidemment, les deux cas ne sont pas exclusifs et plusieurs exemples documentés font état d’un impact de la TAC sur les Salmonidés natifs et sur d’autres taxons de manière simultanée. Un exemple particulièrement illustratif fut décrit par Colden V. Baxter et ses collègues en 2004, au Japon : l’introduction de la TAC dans le Nord du pays, région où l’on trouve l’omble Dolly Varden (Salvelinus malma). L’arrivée de la TAC, rapidement en compétition avec l’omble natif pour la nourriture (insectes terrestres tombant dans l’eau), provoqua un changement notable de comportement chez ce dernier. Ainsi, les populations de S. malma se rabattirent sur les insectes aquatiques, provoquant non seulement une augmentation importante de la biomasse algale dans ces rivières – la nourriture principale desdits insectes aquatiques–, mais aussi des réductions importantes d’effectifs chez les espèces d’araignées de la ripisylve, espèces spécialisées dans la capture des insectes aquatiques en émergence bien moins présents qu’auparavant car boulotés par les ombles natifs privés de leur nourriture habituelle (Baxter et al., 2004).
Interactions avec les autres Salmonidés
Passons rapidement sur les risques d’introgression génétique, qui ne nous concernent pas réellement en France, car aucune espèce capable de s’hybrider avec la TAC sans intervention de l’homme n’y est présente (l’hybridation entre la S. trutta et O. mykiss est possible in vitro, donnant des hybrides triploïdes stériles) (Blanc & Maunas, 2005 ; Bozkurt & Yavas, 2014). Ce phénomène pose cependant plus de problème outre-Atlantique, où la TAC s’hybride « naturellement » (ie sans intervention directe de l’homme) avec plusieurs autres truites du genre Oncorhynchus, comme la truite Gila (O. gilae), la truite Apache (O. apache), la truite dorée (O. aguabonita) ou encore la truite fardée (O. clarkii), pour lesquelles ces phénomènes d’introgression ont menés à la disparition de certaines populations (Bartley, 1991 ; Dowling & Childs, 1992).

Attardons-nous sur les interactions avec les autres Salmonidés, et plus particulièrement avec la truite commune, qui reste la principale source d’interrogations chez nous. Plusieurs cas de compétition entre les deux espèces ont été documentés, principalement en Europe où la truite commune est native, mais aussi sur des localités où les deux espèces sont exotiques. On peut également noter que la truite commune ne semble pas menacer la TAC sur son aire de répartition d’origine, où elle a été introduite (je n’ai en tout cas trouvé aucune étude publiée sur le sujet).
Lorsque les deux espèces ont été introduites dans les mêmes eaux, aucune tendance claire ne semble apparaître sur une domination d’une espèce par une autre : dans un cas, la TAC prendra le dessus, comme dans certaines eaux de Nouvelle-Zélande (Scott & Irvine, 2000), dans d’autres la truite commune sera gagnante, comme au Nord du Japon (Hasegawa, 2016).
Cependant, plusieurs situations de dégradations nettes des populations européennes de truites communes après introduction de la TAC sont rapportées, avec parfois des proportions dramatiques. Au Liechtenstein par exemple, le ratio S. trutta/O. mykiss est passé de 10 pour 1 à 1 pour 10 en moins d’un siècle ; dans la rivière Gail (Sud de l’Autriche), une telle inversion d’effectifs s’est également observée (3 pour 7 à 2 pour 8 en 10 ans). En Suisse, en Allemagne, en Hongrie et en Slovénie, la TAC est impliquée dans le déclin de populations de truites communes autochtones. Le principal phénomène évoqué est la compétition pour les zones de frai : bien que les TAC fraient de manière plus tardive (début du printemps), leur activité de nidification perturbe le bon déroulement de la maturation des œufs de truite commune. En posant leurs œufs, les TAC « déterrent » ceux des communes précédemment pondus, compromettant leur survie. Plusieurs cas de compétition sévère ont également été observés avec l’Ombre commun (Thymallus thymallus) en Autriche, encore une fois autour des zones de reproduction, qui coïncident en matière de substrat et de période avec celles de la TAC bien plus nettement qu’avec celles de la truite commune (Stanković et al., 2015).
La TAC, tueuse en puissance de salmonidés autochtones ?
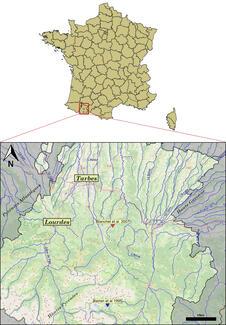
C’est là qu’il convient de nuancer le propos vis-à-vis du contexte français. Un élément assez important doit être pris en compte : le maintien des populations après arrêt des empoissonnements, par reproduction naturelle. Car c’est bien cet aspect, la compétition – en particulier pour les frayères – qui apparaît être le principal problème, la prédation d’œufs et de juvéniles de Salmonidés autochtones étant peu documentée en Europe. Et c’est d’ailleurs dans les pays qui ont vu apparaître des populations fonctionnelles de TAC que les impacts ont été les plus notables, alors que cela semble beaucoup plus limité dans les localités où celle-ci ne s’installe pas. Et c’est notamment le cas de la France métropolitaine, où mise à part la bien connue population des Bouillouses (Pyrénées Orientales) et deux populations dans la Vallée de l’Ourse (Hautes-Pyrénées) (Pascal et al., 2006 ; Delacoste & Baudier, comm. pers.), aucune autre localité n’a (selon nos sources) vu apparaître de reproduction réellement fonctionnelle. Des reproductions ponctuelles sont bien observées ça et là – notamment dans le Sud de la France, mais aussi plus récemment dans les Alpes du Nord (Stanković et al., 2015 ; Baglinière et al., 2020) –, mais ces dernières n’ont jamais constitué de populations pérennes.
De plus, bien que la reproduction naturelle de l’espèce soit mal connue chez nous du fait du très faible nombre de populations acclimatées, la ponte plus tardive des TAC exposeraient les alevins à une hydrologie incompatible avec leur émergence. Enfin, les températures sont souvent trop hautes l’été pour le maintien de l’espèce, particulièrement en ce qui concerne les poissons introduits sur des zones « à ombre » ou « à barbeau », correspondant généralement aux limites 1ère/2nde catégorie. Tout ceci semble pour le moment empêcher l’installation de l’espèce dans la majorité des endroits où sont effectuées des introductions et lâchers (Kottelat & Freyhof, 2007).

Il apparaît donc que la TAC, au moins sur ces aspects, ait peu de chances de peser globalement sur la pérennité des populations de truite commune en France. Du moins pour le moment, car la ponte décalée et se déroulant à de plus hautes températures pourrait possiblement avantager l’espèce dans un contexte de changement climatique.
Mais qu’en est-il de la compétition pour les ressources et l’habitat ? Ici encore, difficile de trouver une tendance claire. Bien que la TAC soit souvent donnée comme moins agressive que la truite commune (Baran et al., 1995 ; Baglinière et al., 2020), des travaux extérieurs à la France ont montré que cette dernière pouvait sembler moins compétitive dans certains contextes (Gatz et al., 1987 ; Scott & Irvine, 2000). Le cas français est particulièrement illustratif, car à notre connaissance, seulement deux études se sont intéressées aux interactions entre la TAC et la truite commune chez nous, ceux de Baran et al. (1995) et Blanchet et al. (2007). Et ces travaux, séparés d’une décennie, montrent des résultats différents malgré des contextes méthodologique (étude de la compétition via observation de l’utilisation de l’habitat) et géographique similaires (les deux études ayant été menées dans les Hautes-Pyrénées, voir Figure 5). Les travaux de 1995 trouvent une population de TAC « souffrant » de la présence de la truite commune (abondance plus faible qu’en cas de présence seule de TAC), alors que ceux de 2007 montrent au contraire un taux de recapture plus faible de truite commune en présence de TAC. Précisons tout de même que l’étude de 2007 se concentraient sur les juvéniles.
Plus globalement, plusieurs situations où la TAC ne semble pas interférer avec les Salmonidés autochtones sont rapportés, et il semble donc bien que les cas de compétition entre les deux espèces soient dépendants du contexte. Cette observation est confirmée par les gestionnaires sur certains départements (Delacoste & Baudier, comm. pers.). Par exemple, l’arrivée de la TAC sur le secteur des Bouillouses, peu après la construction du barrage au début du XXème siècle, n’a pas éliminé la truite commune présente sur le secteur. Cette grande variabilité dans les possibilité de compétition semble d’ailleurs être une tendance globale chez les Salmonidés si l’on observe les cas Outre Atlantique (Gatz et al., 1987).
Et pour les autres taxons ?
Un aspect déjà plus consensuel de l’impact de la TAC dans les milieux où elle est introduite concerne la prédation sur d’autres taxons, comme les petits poissons bien évidemment, mais aussi les insectes et les amphibiens. Dans de nombreuses régions du monde, la TAC est impliquée dans le déclin de populations de petits poissons autochtones notamment en Amérique du Sud et en Afrique. C’est d’ailleurs l’une des principales menaces qui pèsent sur la famille des Galaxiidés, notamment en Patagonie (Stanković et al., 2015). Avec parfois des adaptations surprenantes de la TAC, capable de sortir volontairement de sa plage de préférence thermique pour aller chercher des espèces auparavant protégées par les températures des eaux dans lesquelles elles vivent (Quiroga et al., 2017).
Cet aspect semble être beaucoup moins soumis à la nécessité d’une reproduction naturelle des TAC pour que les impacts soient réels, les poissons lâchés finissant bien par manger autre chose que des pellets. Chez nous, l’éventuelle surprédation sur certaines espèces comme les loches ou les chabots, qui pourrait être provoquée par les introductions de salmonidés, n’a pas été étudiée. Cependant, plusieurs travaux mettent en évidence un impact significatif sur les populations d’amphibiens en lacs et cours d’eau de haute montagne (Pascal et al., 2006).
Cependant, les effets de cette prédation, que cela soit dans l’hémisphère Sud ou en haute montagne, ne sont pas cantonnés à la TAC, mais sont bien provoqués par tous les Salmonidés introduits dans ces milieux, souvent initialement vierges de toutes espèces piscicoles prédatrices (voir d’espèces piscicoles tout court, pour nos lacs de montagne par exemple). La question, pour ces milieux, n’est donc pas « TAC ou pas TAC », mais bien « Salmonidés ou pas Salmonidés ».
D’autant plus que vraisemblablement, l’immense majorité des TAC lâchées en France n’auraient pas vraiment le « temps » de faire des dégâts, car très exposées à la pression de pêche et aux prédateurs, bien que des travaux récents aient montré la conservation des instincts de fuite chez des « souches » de piscicultures, face à des prédateurs comme le brochet (Kopack et al., 2015).
Reste un cas particulier dans le contexte français : celui de la Réunion, où quelques populations se sont acclimatées, ce qui reste exceptionnel en contexte tropical. Introduite dans les années 1940 sur l’île, qui est un hotspot de biodiversité remarquable, la TAC y est soupçonnée de prédation sur des espèces endémiques (ie qu’on ne trouve qu’à la Réunion). La Fédération Départementale étudie actuellement la question, avec toutefois un impact qui serait moindre que soupçonné (Baglignière, comm. pers.). Affaire à suivre, donc...
Pour terminer, il est important de mentionner que comme beaucoup d’animaux d’élevage, la TAC peut être vectrice de pathogènes touchant les autres Salmonidés (PKD, Furonculoses, « maladie du tournis », vers parasites…ect) (Stanković et al., 2015), mais aussi pour les amphibiens (saprolégnioses spécifiques des batraciens parfois présentes sur les œufs de truite) (Martín-Torrijos et al., 2016). Bien connues en piscicultures, les maladies en question le sont beaucoup moins en milieu naturel, les suivis étant très difficiles à mettre en place. Le transport de ces pathogènes – voire leur émergence – est un vaste sujet, qui mérite un article à part entière, tout comme les impacts écologiques directs de la pisciculture (dégradation de la qualité de l’eau, rejet de médicaments, etc). Cependant là encore, il ne s’agit pas d’un problème inhérent à la TAC, mais bien d’un sujet vétérinaire au sens général, extensible à tous les Salmonidés d’élevage.

Pour résumer :
- La TAC est l'un des poissons les plus introduits dans le monde, avec de nombreux impacts écologiques rapportés.
- Les impacts spécifiques à la TAC concernent principalement des interactions avec des Salmonidés autochtones, et sont fortement dépendants de l'existence d'une reproduction autonome de l'espèce.
- La France métropolitaine semble, pour le moment, peu soumise à ces risques, mais la situation est à surveiller dans le contexte de changement climatique.
- La majorité des impacts qui lui sont reprochés sont transposables à d’autres espèces de Salmonidés.
Que faut-il retenir de tout ça ? Hé bien…On retiendra surtout qu’on connait très mal la biologie de la TAC chez nous, à l’instar de la plupart des autres espèces de poissons introduites en France, qui représentent tout de même 25% de la biodiversité piscicole d’eau douce de l’Hexagone (UICN, 2019). Peu de travaux ont eu pour objet d’observer l’impact que pouvaient avoir les poissons exotiques, en particulier ceux d’intérêt halieutique. À l’heure où il faut plus que jamais montrer notre engagement pour la préservation des milieux aquatiques – aussi bien pour des raisons pragmatiques que politiques – nous devons en savoir plus sur l’impact de notre gestion et l’ajuster au mieux. Car il s’agit non seulement de ne pas nuire à nos peuplements autochtones – de poissons, évidemment, mais aussi d’amphibiens, de crustacés, d’insectes, qui font partie intégrante des « Milieux Aquatiques » cités dans les noms de nos structures ! – mais aussi d’éviter de devenir le bouc émissaire idéal de problématiques écologiques ne concernant, finalement, pas (ou peu) la pêche. Concéder que des poissons que nous apprécions puissent avoir un impact, sans pour autant les laisser devenir l’arbre qui cache la myriade de menaces qui pèsent sur nos cours et plans d’eau !
Remerciements
Un grand merci à tout ceux qui ont participé à la documentation et permis l’écriture de cet article :
- Jean-Luc Baglignière (INRAE)
- Simon Blanchet (CNRS)
- Marc Delacoste (FDPPMA65)
- Olivier Baudier (FDPPMA66)
- David Arles (AAPPMA « La Gauloise », Lodève)
Bibliographie
Baglinière J-L., Poulet N. & Ombredane D. – La Truite Arc en Ciel, dans Keith P., Poulet N., Denys G., Changeux T., Feunteun É. & Persat H. (coord.) (2020). — Les Poissons d'eau douce de France. Deuxième édition. Muséum national d'Histoire naturelle, Paris ; Biotope, Mèze, 704 p. (Inventaires & biodiversité ; 18).
Baran, P., Delacoste, M., Lascaux, J. M., Bauba, F., & Segura, G. (1995). La compétition interspécifique entre la truite commune (Salmo trutta L.) et la truite arc-en-ciel (Oncorhynchus Mykiss Walbaum): influence sur les modèles d'habitat. Bulletin Français de la Pêche et de la Pisciculture, (337-338-339), 283-290
Bartley, D. M. (1991). Genetic identification of native cutthroat trout (Oncorhynchus clarki) and introgressive hybridization with introduced rainbow trout (O. mykiss) in streams associated with the Alvord Basin, Oregon and Nevada. Copeia, 1991(3), 854-85).
Baxter, C. V., Fausch, K. D., Murakami, M., & Chapman, P. L. (2004). Fish invasion restructures stream and forest food webs by interrupting reciprocal prey subsidies. Ecology, 85(10), 2656-2663.
Blanc, J. M., & Maunas, P. (2005). Farming evaluation of the brownbow triploid hybrid (Oncorhynchus mykiss Salmo trutta). Aquaculture International, 13(3), 271-281.
Blanchet, S., Loot, G., Grenouillet, G., & Brosse, S. (2007). Competitive interactions between native and exotic salmonids: a combined field and laboratory demonstration. Ecology of Freshwater Fish, 16(2), 133-143.
Bozkurt, Y., & Yavaş, İ. (2014). Preliminary study on hybridization of brown trout (Salmo trutta macrostigma) and rainbow trout (Oncorhynchus mykiss) using cryopreserved sperm. The Israeli Journal of Aquaculture-Bamidgeh.
Crawford, S. S., & Muir, A. M. (2008). Global introductions of salmon and trout in the genus Oncorhynchus: 1870–2007. Reviews in Fish Biology and Fisheries, 18(3), 313-344.
Cucherousset, J., Lassus, R., Riepe, C., Millet, P., Santoul, F., Arlinghaus, R., & Buoro, M. (2021) – Quantitative estimates of freshwater fish stocking practices by recreational angling clubs in France. Fisheries Management and Ecology.
Dowling, T. E., & Childs, M. R. (1992). Impact of hybridization on a threatened trout of the southwestern United States. Conservation Biology, 6(3), 355-364.
FAO – Register of International Introductions of Inland Aquatic Species [En ligne] http://www.fao.org/3/X5628E/x5628e0e.htm#salmo%20gairdneri%20(richardson):%20salmonidae (consulté le 25/05/2021)
Gatz, A. J., Sale, M. J., & Loar, J. M. (1987). Habitat shifts in rainbow trout: competitive influences of brown trout. Oecologia, 74(1), 7-19.
Hasegawa, K. (2016). The density dependent interspecific competition between nonnative salmonids, rainbow trout and brown trout. Environmental biology of fishes, 99(4), 433-438.
Keith, P., & Allardi, J. (1997). Bilan des introductions des poissons d'eau douce en France. Bulletin Français de la Pêche et de la Pisciculture, (344-345), 181-191.
Kopack, C. J., Broder, E. D., Lepak, J. M., Fetherman, E. R., & Angeloni, L. M. (2015). Behavioral responses of a highly domesticated, predator naïve rainbow trout to chemical cues of predation. Fisheries Research, 169, 1-7.
Kottelat, M., & Freyhof, J. (2007). Handbook of European freshwater fishes. Publications Kottelat.
Lowe, S., Browne, M., Boudjelas, S., & De Poorter, M. (2000). 100 of the world's worst invasive alien species: a selection from the global invasive species database (Vol. 12). Auckland: Invasive Species Specialist Group.
MacCrimmon, H. R. (1971). World distribution of rainbow trout (Salmo gairdneri). Journal of the Fisheries Board of Canada, 28(5), 663-704.
Martín-Torrijos, L., Sandoval-Sierra, J. V., Muñoz, J., Diéguez-Uribeondo, J., Bosch, J., & Guayasamin, J. M. (2016). Rainbow trout (Oncorhynchus mykiss) threaten Andean amphibians. Neotropical Biodiversity, 2(1), 26-36.
Pascal, M., Lorvelec, O., & Vigne, J. D. (2006). Invasions Biologiques et Extinctions: 11 000 ans d'histoire des Vertébrés en France (pp. 352-p). Editions Quae.
Quiroga, S., Kacoliris, F., García, I., Povedano, H., Velasco, M., & Zalba, S. (2017). Invasive rainbow trout Oncorhynchus mykiss preying on the endangered naked characin Gymnocharacinus bergii at its thermal limits. Journal of fish biology, 91(6), 1745-1749.
Scott, D., & Irvine, J. R. (2000). Competitive exclusion of brown trout Salmo trutta L., by rainbow trout Oncorhynchus mykiss Walbaum, in lake tributaries, New Zealand. Fisheries Management and Ecology, 7(3), 225-237.
Stanković, D., Crivelli, A. J., & Snoj, A. (2015). Rainbow trout in Europe: introduction, naturalization, and impacts. Reviews in Fisheries Science & Aquaculture, 23(1), 39-71.
UICN Comité français, MNHN, SFI & AFB (2019). La Liste rouge des espèces menacées en France – Chapitre Poissons d’eau douce de France métropolitaine. Paris, France.
Welcomme, R. L. (Ed.). (1988). International introductions of inland aquatic species (Vol. 294). Food & Agriculture Org.
Wittenberg, R., & Kenis, M. (2005). An inventory of alien species and their threat to biodiversity and economy in Switzerland. CABI Bioscience Switzerland Centre report to the Swiss Agency for Environment, Forests and Landscape, 417.






